[027] ペプチド結合 peptide bond (GB#101D02) | 基礎医学教育研究会(KIKKEN)Lab
●アミノ酸はすべて同じ方法でつながっている
タンパク質(protein)の部品がアミノ酸(amino acid)で,タンパク質はアミノ酸が一列に鎖状につながってできた巨大分子だ。 私たちの体の中で部品になるアミノ酸は20種類あって,構成するアミノ酸の数や種類と順番によって,できあがるタンパク質のかたちや働きがほぼ決まってしまう。 20種類のアミノ酸もそれぞれ分子のかたちが違うけれど,すごいのは,どのアミノ酸もすべてひとつの同じ方法で連結することができるというところだ。
—
・・・続きを読む
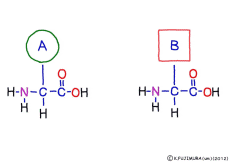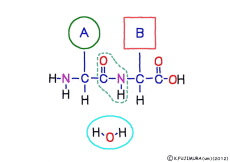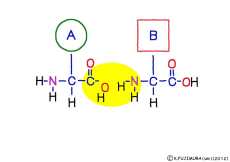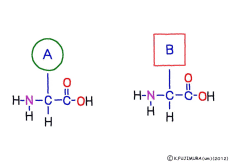
この連結は,つながるときに水分子ができる脱水縮合のひとつで,ペプチド結合(peptid bond)という名前がついている。 ペプチドというのはアミノ酸どうしが繋がってできた大きな分子のことだ。
Contents
●ペプチドとタンパク質は同じもの?
アミノ酸が連結してできた化合物がペプチドなので,タンパク質もペプチドなのだけど,普通はアミノ酸の数が少ない分子をペプチド,大きな分子をたんぱく質と言っているようだ。 だいたい50個以上だとタンパク質というらしい。 しかし別の本では20個以上のものをタンパク質というとある。 ちょっと大きなペプチド(オリゴペプチド,oligopeptide),けっこう大きなペプチド(ポリペプチド,polypeptide)という言い方もある。 10個以上のものをポリペプチドというようだけど,明確な境目はつけにくい。
(※oligoというのは「少ない」ことかと思っていたら,「多い」という意味だという本があるのでびっくり。)← wikipedia ではやっぱり「オリゴ」は「少ない」を意味する oligos というラテン語から来ていると書いてあるね。
追記:文部科学省のサイトによると,「2から20程度のアミノ酸が結合したペプチドをオリゴペプチドと総称する(IUPAC&IUBMB-1983)」ということだ。(2018-04-27)
ほかにアミノ酸2個のペプチド(ジペプチド,dipeptide),アミノ酸3個のペプチド(トリペプチド,tripeptide)とか,いろんなペプチドの呼び方がある。 ただし2個や3個のペプチドはいかにも断片という感じがするけど、それ以上のペプチドでは(片づけられる途中の断片じゃなければ)大きさと仕事の重さとはなんの関係も無い。 (健康な)細胞で作られるペプチドは全部,大きさに関係なく,アミノ酸の順番と種類を厳密にコントロールされた作品で,それなりに重要な仕事をもっていると言っていい。 タンパク質という言葉はポリペプチドがさらに機能的にも完成したものをいうらしい。
(ここから先はタンパク質もふくめていろんな大きさのものを一緒にしてポリペプチドと表すことにする。)
●アミノ酸はそれぞれ個性を持っている
ポリペプチドの部品である20種類のアミノ酸はおおざっぱに分けると,水分子となじみが良い(親水性のある)アミノ酸と,水分子とは折り合いが悪い(親水性がない・疎水性のある)アミノ酸の二通りがある。 親水性のあるアミノ酸には塩基性アミノ酸,酸性アミノ酸が含まれる。 塩基性アミノ酸は水酸化物イオン(OH–)を,酸性アミノ酸は水素イオン(H+)を発生するから,アミノ酸そのものはそれぞれプラス,マイナスの電気をもつことになる。 電気を持たない親水性アミノ酸もある。 その基本的な性質のほかにアミノ酸はそれぞれ特有の性質や役割を持っていて,その特性や構造はばらばらだ。 しかし一方で,アミノ酸はすべてに共通している重要な構造がある。
●アミノ酸は同じ連結器を持っている
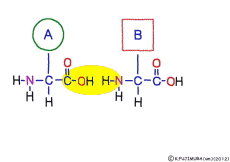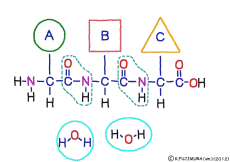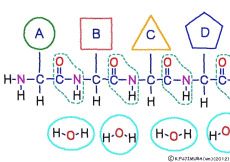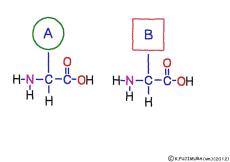
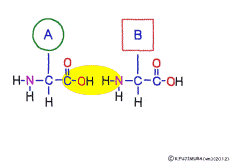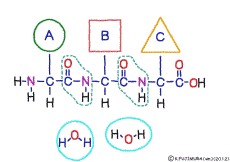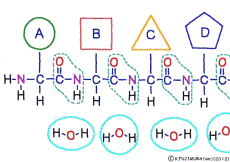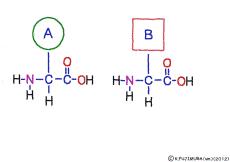
アミノ酸の特徴は,その構造の一端に必ず連結用の(NH2-CH-COOH)という決まったかたちを持っているということだ。 左側の NH2 はアミノ基(amino group),右側の COOH はカルボキシ基(carboxy group,昔はカルボキシル基と言っていたがいつのまにか国際基準で変更されたらしい。)という名前がついていて,アミノ基のある側をアミノ末端(N末端,N-terminus,N-terminal end),カルボキシ基のある側をカルボキシ末端(C末端,C-terminus,C-terminal end)と呼ぶ。 ひとつのアミノ酸を描くとき,左側に N末端,右側に C末端を描くのはお約束だ。 それぞれのアミノ酸では N末端と C末端は離ればなれになっているけれど,N末端は別のアミノ酸の C末端と,C末端は別のアミノ酸の N末端としっかり結合するようになっている。 右でも左でも結合そのものは -COOH 対 NH2– という同じ形式になるところがミソだ。 これが -CONH- というペプチド結合になる。
つまりアミノ酸はいろいろな種類があるけれど,全部同じしくみでつなげることができるということだ。 逆に言うと,同じつなぎ方をするけれどいくつでも違うポリペプチドを作ることができることになる。
●ペプチドには前後がある
ペプチド結合には N末端と C末端という,前と後みたいな違いがあるから一連につながったポリペプチドの構造にも前と後がある。 ペプチドの頭は N末端側だ。 これはポリペプチドが作られるときの仕組みによる。 ポリペプチドは細胞の中で作られるときは,元になるアミノ酸あるいはペプチドの C末端に新たなアミノ酸ひとつを連結するという方法しか使えないからだ。 その仕組みを説明するには普通は前置きがとてつもなく長くなる。 その長い前置きは別に譲って,ここでは連結するところだけに絞っていこう。
●アミノ酸の連結にはエネルギーがいる
ペプチド結合に限らず,脱水縮合で二つの分子を連結した物質は,それぞれ単独の分子の持つエネルギーを足し合わせたものより高いエネルギーを持っている。 エネルギー物質として有名なアデノシン三リン酸(ATP) のリン酸結合は,7.3 kcal/mol のエネルギーを持っているのに比べて,ペプチド結合の場合は 0.5 kcal/mol 程度らしいけど,バラバラのときよりも高いことにかわりない。 これは連結したらエネルギーが自然に高くなるということはなくて,どこからか余分なエネルギーを持ってきて注入しないと絶対に連結しないということだ。 実際に反応を進めるためには,結合のためのエネルギーよりさらに大きな「活性化エネルギー」が必要になる。
●アミノ酸はひとつずつ選ばれて連結される
ペプチドは細胞質にあるリボソーム(ribosome)という巨大な分子の道具を使って作られる。 リボソームは作りかけのペプチドに順番に新しいアミノ酸を連結する。 しかし材料になるアミノ酸は単独で泳いでこない。 アミノ酸はまずそのアミノ酸に固有の転位 RNA (=運搬 RNA:transfer RNA,tRNA)という運搬係の分子に C末端で結合されている。 これはアミノアシル tRNA 合成酵素(aminoacyl tRNA synthetase)という酵素がアデノシン三リン酸(ATP)のエネルギーを使ってつなぐ(※)。 このアミノ酸と tRNA の連結は,アミノ酸どうしのペプチド結合の活性化エネルギーよりも高いエネルギーを持っている。
※ここはよくある ATP ⇒ ADP + Pi(リン酸) ではなくて,ATP ⇒ AMP + PPi(ピロリン酸)という反応だという。
材料のアミノ酸は tRNA と繋がった状態でリボソームの中に入る。 リボソームの中では,作りかけのポリペプチドはその一番はしっこのアミノ酸の C末端が先に来ていた tRNA と結合した状態にある。 新しく入ってきたアミノ酸の N末端が作りかけのポリペプチドのアミノ酸の C末端近くにセットされたら,この C末端から先客の tRNA が切り離されて,そこで開放されたエネルギーを使って,裸になった C末端と新しいアミノ酸の N末端が連結される。 あとはこの繰り返しだ。 リボソームと rRNA の働きでペプチドにひとつずつ選ばれながら,新しいアミノ酸が追加されて長い鎖のポリペプチドが作られていく。
(※今回のアニメは tRNA の関わりはまったく省略しています。)
出来上がったポリペプチドは,構成するアミノ酸の種類や位置による特性の影響でなかば自動的に折れ曲がって特有の立体構造をとって,そのポリペプチド特有の機能を持つようになる。
出来上がったポリペプチドの両端は N末端と C末端がつながって輪っかになったりしないのか。 化学構造的には可能かどうか知らないけど,ポリペプチドはアミノ酸を一個ずつ連結する仕組みしか持っていない細胞には,その芸当は無理だろう。 ずらずらと長いポリペプチドを引き連れた N末端を C末端に連結するには別の特別な仕組みが必要だ。
●ポリペプチドの始まりには決まりがある
ポリペプチドの合成は N末端のアミノ酸が先頭になる。 N末端のアミノ酸は,何を選んでも後の連結は可能だ。 しかし実際にポリペプチドを合成する段階では,始まりのアミノ酸は特別な存在だ。 すでにある列のおしりに着くのと先頭になるのとでは立場が全然違うからだ。 結局,合成が始まるとき,先頭になれるのはメチオニン(methionine)という特定のアミノ酸を結合した特別の tRNA だけに限られている。 その後にいろんなアミノ酸が連結していくのは自由だ。 そうすると,出来上がったポリペプチドはみな先頭がメチオニンなのかというと,そんなことはない。 実際,いろんなアミノ酸が先頭になっている。 合成が終わった時,先頭のメチオニンは(必要がなければ)切り捨てられて,できあがりのポリペプチドの先頭になっているのは2番目(以降)のアミノ酸なのだ。
●ペプチドは加水分解でアミノ酸が切り離される
ペプチド結合は脱水縮合のひとつだ。 3大栄養素である糖質,脂質,タンパク質はすべてそれぞれの要素分子の脱水縮合でできている。 いずれも食物として取りこんで消化管で消化吸収されるときには,逆の反応である加水分解によって要素分子にばらされて細胞に吸収される。 グリコーゲン(でんぷん)は加水分解でグルコースに,脂質は加水分解でグリセリンと脂肪酸に,そしてたんぱく質は加水分解でアミノ酸にという具合だ。 この反応も進めるには特別の酵素と活性化エネルギーが必要なことは言うまでもない。 水の中に混ぜればひとりでに分解する,ということは(ほとんど)おこらない。
●ペプチドの分解は意外と手間がかかる
ポリペプチドはアミノ酸の種類は違っても,同じペプチド結合という形式で繋がっているので,分解するときにはひとつのやり方で簡単にいくのかと思ったら,実はそれどころか逆に大変めんどうだ。 体のなかで分解作業を行うには酵素タンパクが働かないと無理だけど,酵素が得意なのはもともと,ある程度の大きさの決まった構造を見つけて切るという作業だ。 ペプチドはそれぞれ種類によって構造が大きく違うし,どこかを切れば,それで切れたペプチドの構造は変わってしまうから,その酵素は相手ができなくなる。 ひとつのポリペプチドの「ペプチド結合をすべて切る」という酵素は存在しないのだ。 そのため,ポリペプチドの分解には,大雑把に大きなポリペプチドの,切れるところを見つけてぶつ切りにする酵素,特定のペプチドをぶつ切りにする酵素,ぶつ切りになったペプチドをまたぶつ切りにする酵素,あるいはぶつ切りされたペプチドの端からひとつずつアミノ酸を切り離す酵素など,いくつものタイプの酵素が関わっている。
↑ 記事を折りたたむ
○関連するリンク
⇒タンパク質中の20種類のアミノ酸,生活環境化学の部屋, 2017..
⇒それぞれのアミノ酸にさまざまな機能(味の素)【リンク切れ】⇒ 味の素・アミノ酸大百科, 2017.:https://www.ajinomoto.co.jp/amino/.
⇒リボソーム:wikipedia.
⇒転位RNA:wikipedia
⇒最近,話題のコラーゲンについて.
⇒アミノ酸の解説(文部科学省)
○関連する記事
◆[007] ブドウ糖と,ショ糖の加水分解 glucose and the hydrolysis of sucrose ![]()
◆[017] 糖質の吸収 absorption of carbohydratel ![]()
◆[019] アデノシン三リン酸(ATP) adenosine triphosphate ![]()
◆[011] 体内の酸性・アルカリ性と炭酸ガス body acid-base reaction and carbon dioxide gas ![]()
◆[030] エンドサイトーシスと細胞内消化 endocytosis and intracellular digestion ![]()
◆[032] グリコーゲンの合成 glycogen synthesis ![]()
◆[046] 消化と代謝 digestion and metabolism ![]()
○参考文献
・プロッパー細胞生物学,化学同人
・ワトソン遺伝子の分子生物学 第6版 東京電機大学出版局
・マッキー生化学―分子から解き明かす生命 化学同人
・Essential細胞生物学〈DVD付〉原書第3版,南江堂
・細胞の分子生物学, ニュートンプレス; 第5版 (2010/01)
・肉単―ギリシャ語・ラテン語 (語源から覚える解剖学英単語集 (筋肉編))
・カラー図解 人体の正常構造と機能 全10巻縮刷版,坂井 建雄,日本医事新報社
・人体機能生理学,杉 晴夫,南江堂
・トートラ人体解剖生理学 原書8版,丸善
・イラスト解剖学,松村 讓兒,中外医学社
・柔道整復学校協会編「生理学」,南江堂
・東洋療法学校協会編「生理学」,医歯薬出版株式会社
rev.20150909, rev.20160627, rev.20180130, rev.20180428, rev.20180429., rev.20220704.
◆基礎医学教育研究会(KIKKEN)









コメント
豊田様,コメント有難うございます.人工的なアミノ酸より天然アミノ酸のほうが良い働きをするというのは何を指しているのかはっきりしませんが,もしかすると,光学異性体に関することかもしれません.アミノ酸(に限りませんが)は,化学組成では区別できませんが,立体的な構造では,ある構造とそれが鏡に映った形の構造の二通り可能です.鏡に映った形で異なるので光学異性体といいます.生物の世界では立体構造も厳密に区別するので,その片方の構造のアミノ酸しか作らないし,使えません.ところが人工的な化学反応でアミノ酸を作ると,どちらの立体構造も同時にできてしまうので,単純に考えると,半分は生物的には使えないアミノ酸になってしまうことになります.働きが良くないというのはそういうことではないでしょうか.後半の話も,立体構造が合わないと,使えるタンパク質も作れないということではないでしょうか.光学異性体で調べてみてください.
大変参考になります。処でアミノ酸は人工よりも天然の方が良い働きをすると聞きます。又同種の生物の天然アミノ酸20種を使用した物がたんぱく質の効果を高めると効きます。本当でしょうか。本当で有れば理由も含めて、お教え頂ければ幸甚です。
15/09/09 15:22にコメントを頂いたKさん、ありがとうございます。
このページは、あまりきちんとした勉強には向きませんが(笑)、
何かご質問やご要望があればお聞かせください。